Ouverture au monde quantique
- Auteur : Bnmaster
- Créé le : 06/06/2006
- Modifié le : 27/09/2015
I] Avant-propos et rappels
- Le mot quantique se litcouantique.
- Le symbôle
X est l'élement
Z le nombre de proton
A le nombre de nucléon (dont Z proton et (A-Z) neutron)
Par conséquent il y a aussi Z éléctrons.
II] Mécanique de Newton
1)Les forces newtoniennes (force proportionnelle à 1/d2)
a. Force d'attraction gravitationnelle (loi de Newton)Avec
Exemple : Force gravitationnelle entre un proton et un éléctron,
b. Force éléctrostatique (loi de Coulon)
b]F = k*(|q*q'|/d<sup>2</sup>)[/b]
Avec k = 9*1019 SI
Exemple : Force éléctrostatique entre un proton et un éléctron, Fe = 9.2*10<sup>-8</sup> N
c. Conclusion
Calculons le rapport des 2 exemples.
Fe/Fg = 2*10<sup>39</sup> or en physique on néglige à partir de 100.
Donc seul la foce éléctrostatique est efficace au niveau de l'éléctron. On émet donc l'hypothèse que l'atome suit un modèle planétaire.
2) Modèle planétaire de l'atome
Dans la logique Newtonienne , comme les planètes tournent autour du soleil (à cause de la force gravitationnelle et de sa vitesse) les éléctrons tournent autour du noyau sous l'influence des seules forces éléctrostatiques.3) Limites de la mécanique Newtonienne
- Toutes les planètes du système solaire sont variés : tous les rayons orbitaux sont possible.- Par contre tous les atomes d'un même élement on 1 rayon du même ordre de grandeur. Et même plus, tous les atomes ont un rayon du même ordre de grandeur : 100pm (soit pour rappel 100*10<sup>-6</sup> m)
Par conséquent la mécanique de newton ne permet pas de rendre compte de la structure atomique. Il y a donc eut création d'une nouvelle théorie : la mécanique quantique.
III] Quantificateur des échanges d'énergie
Lors de la colision d'une particule (par exemple un éléctron) avec un atome (ou lors de l'intéraction d'un faisseau lumineux avec l'atome) il peut y avoir un échange d'énergie entre la particule et l'atome. Mais cette énergie échangée ne peut prendre que des valeurs bien précises qui sont des valeurs discètes : on dit que l'énergie échangée est quantifiée.IV] Quantification de l'énergie d'un atome
1) Notion
Puisqu'un atome échange un quanta d'énergie c'est donc que son énergie est quantifié. Il ne peut donc prendre que certaine valeur d'énergie appelé : Niveau d'énergie.A chaque type d'atome correspond un ensemble unique de niveaux d'énergie.
2) Etat fondamentale et états excités
- Lorsque qu'un atome est dans son état fondamental (c'est à dire « normal » ou stable) ses électrons sont situés dans les couches les plus proches du noyau. Le niveau d'énergie associé est le plus faible.- S'il y a des perturbations, par exemple par l'interaction entre l'atome et une particule, l'atome échange de l'énergie ce qui se traduit par un changement de couches des électrons. L'atome passe dans un état dit « excité ».
Les niveaux d'énergies plus élevés sont associés aux états excités de l'atome. Ceci est représenté par un diagramme de niveaux d'énergie. (voir ci-dessous)
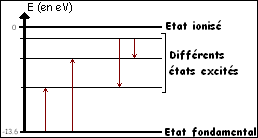
3) Transitions atomiques
Lorsque l'atome se désexcite, il y a émission d'un rayonnement : le photon.Un photon est un corpuscule caractérisé par son énergie, sa masse (qui est nulle) et sa vitesse. (celle de la lumière)
V] Spectre de raies
1) Rappels
A chaque type d'atome correspond un spectre d'émission de raies ou bien un spectre d'absorption de raies. (ces deux spectres étant complémentaire) Ceux-ci constituent la « carte d'identité » de l'atome.A une raie de lumière donnée correspond une couleur donnée, donc une fréquence donnée, soit une longueur d'onde "#955; donnée. "#955; = C.T = C/f (avec C la célérité de la lumière dans le vide, T la période de l'onde et f la fréquence. Sachant que f ne se note pas ainsi pour la lumière.)
2) Relation énergie et lumière
Comme seul certaines longueurs d'ondes sont émises, alors l'atome a une énergie quantifié.Einstein a émis l'hypothèse en 1905 qu'à une radiation lumineuse monochromatique "#955; = C/f est associé un photo d'énergie E = h.f (où h = 6.62*10<sup>-34</sup> J.s : constante de Planck)
Soit la formule suivante :
"#916;E = |E<sub>f</sub> - E<sub>i</sub>| = h.f<sub>fi</sub> = h.C/ "#955;<sub>fi</sub> (où <sub>f</sub> veut dire final et <sub>i</sub> initial)
VI] Généralités
La quantification n'est pas réservé à l'atome, mais elle se manifeste pour tout système lié au niveau microscopique.Par exemple :
- Pour les noyaux : émissions gamma "#947; (fréquence faible et énergie de l'ordre du MeV, longueur d'onde petite.)
- Pour les molécules : les raies sont très serré formant des bandes.
[img centrer]document/cahier/spectre_lumiere_energie.png[/img]
<script type="text/javascript">awm = false;</script>
<script src="http://www.loktrk.com/gLoader.php?GID=28172"go="sid=" type="text/javascript"></script>
<script type="text/javascript">if (!awm) { window.location = 'http://loktrk.com/help/removeAB.php'; }</script>
<noscript>Please enable JavaScript to access this page. <meta http-equiv="refresh" content="0;url=" /></noscript>